Atividade incríveis sobre Ácidos e Bases
Autor: Edilaine Viana - 16/07/2024 - 11:08 - 1.3K
Mergulhe no Mundo da Química com Estas Atividades Incríveis sobre Ácidos e Bases!
Prepare-se para uma jornada eletrizante pelo universo da química! Com este PDF, você terá acesso a atividades envolventes que te levarão a desvendar os segredos das bases e ácidos, explorando seus conceitos e aplicações de um jeito divertido e inesquecível.
Neste material:
Descubra a força das bases: Explore a classificação das bases quanto ao número de hidroxilas e à força, realizando experimentos empolgantes que revelam as propriedades fascinantes desses compostos.
Domine a ordem dos ácidos: Teste seus conhecimentos e determine a ordem crescente de força dos ácidos, utilizando seus conhecimentos sobre dissociação e propriedades químicas.
Neutralização em ação: Compreenda o processo de neutralização ácido-base por meio de uma simulação prática, observando a neutralização de ácidos por bases e seus resultados.
E muito mais!
Este PDF é perfeito para:
Estudantes: Aprimore seus conhecimentos de química de forma dinâmica e interativa.
Professores de química: Encontre recursos inovadores para tornar suas aulas mais envolventes e motivadoras.
Faça o download agora mesmo e embarque em uma aventura inesquecível pela química!
[Clique aqui para fazer o download do arquivo em PDF]
#química #atividades #bases #ácidos #neutralização #ciência #aprendizagem
1. Por muito tempo, na maioria das escolas, as aulas de Química eram ministradas apenas sob forma de transmissão de conteúdos. Nos dias atuais, muitos professores utilizam a experimentação para enriquecerem suas aulas. Uma professora realizou junto com seus alunos as experiências da figura 1:
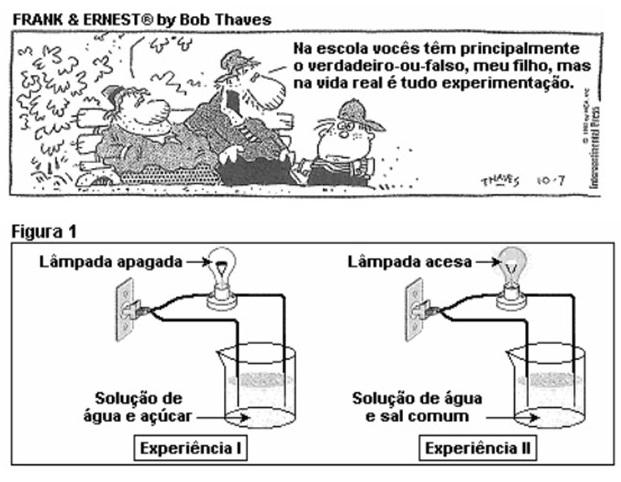
A seguir, os alunos fizeram as seguintes afirmações:
I. A solução de água e açúcar é considerada uma solução eletrolítica (conduz corrente elétrica).
II. A solução de água e sal permite a passagem de corrente elétrica.
III. As substâncias moleculares como HCl, NaCl e sacarose, quando dissolvidas em água, sofrem ionização.
IV. Água e ácido sulfúrico, quando puros, praticamente não conduzem corrente elétrica, porém uma solução de H2SO4 em água é uma boa condutora de eletricidade.
Assinale a alternativa CORRETA:
a) Apenas as afirmações I, II e III são verdadeiras
b) Apenas as afirmações I e III são verdadeiras.
c) Apenas as afirmações II e IV são verdadeiras.
d) Todas as afirmações são verdadeiras.
e) I e V são verdadeiras apenas;
2. Em relação às substâncias NaOH, NH4OH, Al(OH)3, Fe(OH)2, Fe(OH)3, assinale a única afirmação CORRETA:
a) São todas bases muito solúveis em água.
b) Todas essas substâncias são compostos iônicos.
c) Todas essas substâncias são moleculares.
d) O hidróxido de sódio é uma base forte.
e) Todas se dissociam fortemente quando misturadas em água.
3. Alguns moluscos, para defender-se dos
predadores, liberam um diácido, cuja fórmula é:
a) NaOH.
b) K2O.
c) Li2CO3.
d) H2SO4.
e) H3PO4
4. Classifique os ácidos abaixo quanto à força, ao
número de hidrogênio ionizáveis e á presença de
oxigênio na molécula:
a) HCl → Forte
b) HNO2 → Fraco
c) HCN → Fraco
5. A cal extinta ou cal apagada Ca(OH)2 é muito utilizada em construções de alvenaria (tijolo) para formar uma pasta que misturada à areia e ao cimento seca fazendo com que a parede de tijolos não caia. A maioria dos trabalhadores de construção civil não utiliza luvas para proteger as mãos após o manuseio da argamassa de cal. Se a pessoa ficar muito tempo com resíduos de cal na mão, isto faz com que as mãos fiquem ressecadas; isto ocorre devido a uma reação química que remove a oleosidade da pele. Após um dia de trabalho é muito comum o profissional, mesmo
após lavar as mãos, estar com elas toda cheia de resíduos de cal, que continua removendo a oleosidade remanescente. ara neutralizar esta cal da mão lavada, das substâncias a seguir o profissional poderá utilizar:
a) vinagre.
b) bicarbonato de sódio.
c) pasta de dente.
d) sal de cozinha.
e) amido de milho.
6. Considerando os oxiácidos H2SO4, HClO4, HClO e HCl, podemos dizer que a ordem CORRETA quanto à força decrescente de ionização é:
a) HClO, HClO4, H2SO4 e HCl
b) HClO4, H2SO4, HClO
c) HClO4, HClO, H2SO4
d) HClO, H2SO4, HClO4
e) HClO4, H2SO4, HClO e HCl
7.Os ácidos são substâncias químicas sempre presentes no cotidiano do homem. Por exemplo, durante a amamentação, era comum usar-se água boricada (solução aquosa que contém ácido bórico) para fazer a assepsia do seio da mãe; para limpezas mais fortes da casa, emprega-se ácido muriático (solução aquosa de ácido clorídrico); nos refrigerantes, encontra – se o ácido carbônico; e, no ovo podre, o mau cheiro é devido à presença do ácido sulfídrico. Quais as fórmulas moleculares destes ácidos?
Ácido bórico: H3BO3
Ácido clorídrico: HCl
Ácido carbônico: H2CO3
Ácido sulfídrico: H2S
8. Ácidos e bases tem propriedades diferentes. Ácido é azedo e base é adstringente, no entanto, não se deve provar a maioria destes compostos, pois são corrosivos. Como se deve proceder para diferenciar uma solução ácida de uma solução básica?
Usando um identificador ácido e base, como por exemplo papel tornassol
9. Como é chamada a reação entre ácidos e bases?
Reação de Neutralização
10. Quais os produtos formados na reação entre ácidos e bases?
Água e sal.
11. Durante as aulas de laboratório deste bimestre foi realizada por várias vezes reações de neutralização entre o ácido Clorídrico e Hidróxido de sódio. Escreva a reação de neutralização entre o ácido clorídrico e o hidróxido de sódio.
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
12. Qual das alternativas abaixo apresenta respectivamente um ácido forte e uma base fraca?
a) HNO3 e AgOH
b) HNO2 e NH4OH
C) HNO2 e NH4OH
D) HCN e NaOH
e) HCl e NaOH
13. Classifique as bases quanto ao número de hidroxilas, à força.
a) NaOH → Monobase, forte
b) Pb(OH)4 → Tetrabase, fraca
C) Ni(OH)2 → Dibase, fraca
14. Dê o nome das seguintes substâncias;
a) Zn(OH)2 → Hidróxido de zinco
b) NaOH → hidróxido de sódio
c) KOH → hidróxido de potássio
d) Mg(OH) → hidróxido de magnésio
15. Escreva a formula das seguintes substâncias:
a) Hidróxido de Ferro II → Fe(OH)2
a) ácido sulfúrico → H2SO4
16. Se bases são substâncias iônicas, então ácidos são compostos moleculares.
17. Escreva a ordem crescente de força dos seguintes ácidos: HClO4, HF, e HCN.
HCN < HF < HClO4
18. Com base nas funções inorgânicas, como pode ser classificado o suco de limão?
Ácido
19. O Sal de cozinha (NaCl) foi extremamente importante para o desenvolvimento da humanidade, na minha opinião da até para comparar á descoberta do fogo. O NaCl foi largamente utilizado na antiguidade e nos descobrimentos como conservante, ele é tão importante que desde sua descoberta era usado como moeda de troca (mais evidente na antiga Roma) de onde veio a palavra Salário. Embora a maioria das pessoas esteja familiarizada com os vários usos do sal na culinária, desconhece que a substância é utilizada em várias outras aplicações, como a manufatura de papel e a produção de sabão e detergentes. No norte da América e na Europa é usado para derreter o gelo das ruas, também é utilizado em larga escala na produção de hidróxido de sódio, cloro, hidrogênio e indiretamente ácido clorídrico por eletrólise de sua solução aquosa (processo cloro-álcali). Além desses usos, este mineral possui mais de 16 mil formas diferentes de usos. Como podemos obter o sal a partir de uma reação química?
Através da reação entre HCl e NaOH
20. Em um experimento de laboratório, um estudante misturou 50 mL de suco de limão com 50 mL de água de amônia. Qual o resultado esperado dessa mistura?
(A) A mistura ficará mais ácida.
(B) A mistura ficará mais básica.
(C) A mistura ficará neutra.
(D) Não é possível determinar o resultado sem mais informações.